Muối trung hòa là muối trong anion gốc axit không có nguyên tử hidro có thể phân li ra ion H+. Đây là loại muối chiếm tỉ lệ lớn và được ứng dụng nhiều trên thực tế, do đó việc phân biệt là rất cần thiết. Cùng tham khảo thông tin muối trung hòa là gì và cách nhận biết nhanh nhất.
Khái quát về muối trung hòa là gì?

Khái quát về muối trung hòa là gì?
Hợp chất muối sẽ bao gồm 1 hay nhiều cation kim loại hoặc amoni liên kết với 1 hay nhiều anion gốc axit. Muối được phân thành 2 loại dựa theo thành phần là muối trung hòa và muối axit. Trên thực tế muối trung hòa chiếm tỉ lệ lớn và được ứng dụng trong nhiều lĩnh vực như hóa chất, công nghiệp thực phẩm, dược phẩm… Vậy muối trung hòa là muối như thế nào?
Muối trung hòa là muối mà anion gốc axit không còn hidro có tính axit (hidro không có khả năng phân li thành ion H+. Đây là loại muối được tạo thành từ tương tác giữa axit và bazơ hình thành nên dung dịch có pH trung tính từ 7.0 – 7.5.
Ví dụ: Na2SO4, NH4NO3, NaCl, KCl…
HCl + NaOH → NaCl + H2O (NaCl là muối trung hòa)
Muối trung hòa được sử dụng để mô toat về một môi trường trung tính trong cơ thể con người. Ví dụ nước tiểu, máu…
Một số muối vẫn còn hidro như NaH2PO2, Na2HPO3… là trung hòa vì các gốc axit H2PO2–, HPO32- không phân li thành ion H+
Ví dụ: NaH2PO2 ⇄ Na+ + H2PO2–
Na2HPO3 ⇄ 2Na+ + (HPO3)2-
Tính chất nổi bật của muối trung hòa

Muối trung hòa có nhiều tính chất nổi bật khác nhau
Giới thiệu một số tính chất nổi bật của muối trung hòa:
-
Tác dụng với kim loại
Muối tác dụng với kim loại tạo thành muối mới + kim loại mới, với điều kiện kim loại tham gia mạnh hơn kim loại trong hợp chất muối (trừ các kim loại tan như K, Na, Ca, Ba, Li)
Ví dụ: Fe + CuSO4 → FeSO4 + Cu↓
-
Tác dụng với axit
Muối tác dụng với axit tạo thành muối mới + axit mới, với điều kiện muối không tan trong dung dịch tạo thành và axit mới tạo thành phải yếu hơn axit tham gia phản ứng
Ví dụ: BaCl2 + H2SO4 → 2HCl + BaSO4↓
-
Tác dụng với dung dịch bazơ
Dung dịch muối tác dụng với dung dịch bazơ tạo thành muối mới và bazo mới
Ví dụ: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
-
Tác dụng với dung dịch muối
Dung dịch muối tác dụng với dung dịch muối tạo thành 2 muối mới (là dung dịch muối hoặc muối kết tủa), với điều kiện muối tham gia phải tan và sản phẩm phải có kết tủa
Ví dụ: AgNO3 + NaCl → NaNO3 + AgCl↓
-
Phản ứng phân hủy muối
Nhiều muối như KMnO4, KClO3, CaCO3… bị phân hủy ở nhiệt độ cao
Ví dụ: CaCO3 → CaO + CO2
2KClO3 → 2KCl + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
Muối trung hòa và muối axit khác nhau như thế nào?

Muối trung hòa và muối axit khác nhau như thế nào?
Muối axit và trung hòa có tính chất và vai trò khác nhau, điểm khác nhau chính giữa 2 loại muối này như sau:
|
Nội dung |
Muối trung hòa |
Muối axit |
|
Khái niệm |
Là muối mà các anion gốc axit không còn hidro có khả năng phân ly thành ion H+ (hidro có tính axit) Ví dụ: NH4NO3, KCl, NaHCO3… |
Là muối mà các anion gốc axit còn hidro có khả năng phân ly thành ion H+ Ví dụ: KHSO4, NaHCO3 KHSO4 → K+ + HSO4– HSO4– ⇄ H+ + SO42- NaHCO3 → Na+ + HCO3– HCO3– ⇄ H+ + CO32- |
|
Nguyên tắc trung hòa |
Được tạo ra từ phản ứng của 1 axit và 1 bazơ, trung hòa hoàn toàn. Phản ứng loại bỏ tính axit và tính bazo tạo ra muối trung hòa và nước |
Được tạo ra từ phản ứng của 1 axit và 1 bazơ, không trung hòa hoàn toàn và nó có thể còn chứa tính axit hoặc bazơ |
|
Đặc điểm hóa học |
Thường có tính chất trung tính về pH, không có tính bazơ hay axit đặc trưng Ví dụ: NaCl là muối trung hòa |
Muối axit có thể có tính axit còn lại từ đầu Ví dụ: NH4HSO4 là muối axit do NH4+ có khả năng tạo thành H+ trong nước |
Cách nhận biết 10 loại muối trung hòa thường gặp nhất
Để nhận biết muối trung hòa thông thường chúng ta dựa vào nhận biết gốc axit. Dưới đây là tổng hợp cách nhật biết 10 loại muối thường gặp nhất:
1. Cách nhận biết muối clorua (Cl–)
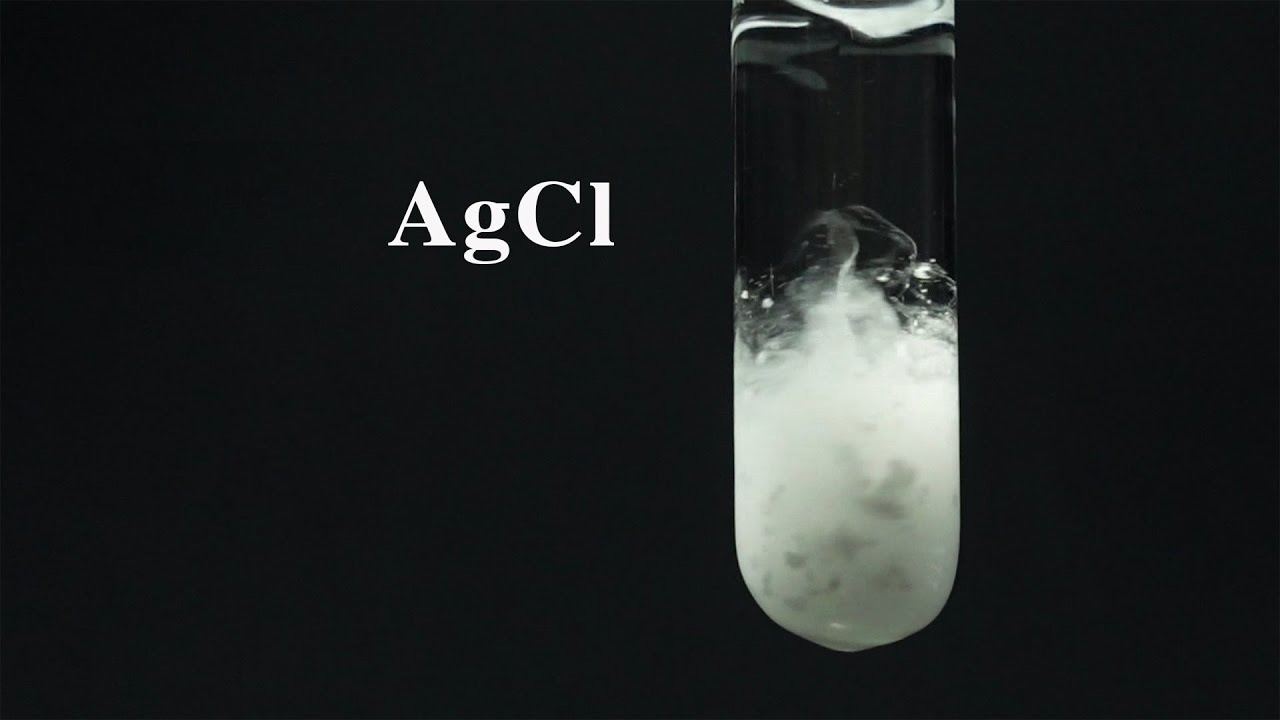
Cách nhận biết muối clorua (Cl–)
Để nhận biết muối clorua sử dụng dung dịch AgNO3 => xuất hiện hiện tượng kết tủa trắng
Ví dụ: NaCl + AgNO3 → AgCl↓ + NaNO3 (AgCl kết tủa trắng) => NaCl là muối trung hòa
NH4Cl + AgNO3 → AgCl↓ + NH4NO3 (AgCl kết tủa trắng) => NH4Cl là muối trung hòa
2. Cách nhận biết muối sunfat (SO4)2-
Sử dụng Ba(OH)2 hoặc dung dịch muối bari nhận biết dung dịch muối sunfat => xuất hiện hiện tượng kết tủa trắng
Ví dụ: Na2SO4 + BaCl2 → BaSO4 ↓ + 2NaCl (BaSO4 kết tủa trắng)
3. Cách nhận biết muối nitrat (NO3)–
Sử dụng vụn kim loại Cu và dung dịch axit loãng HCl hoặc H2SO4 => Xuất hiện hiện tượng thoát khí không màu và hóa nâu trong không khí, dung dịch sau phản ứng có màu xanh
Ví dụ: 3Cu + 8HCl + 2KNO3 → 3CuCl2 + 2KCl +4H2O
2NO +O2 → 2NO2 (Khí NO không màu hóa nâu ngoài không khí)
4. Cách nhận biết muối photphat (PO4)3-
Để nhận biết muối photphat sử dụng dung dịch AgNO3 => xuất hiện hiện tượng kết tủa vàng
Ví dụ: Na3PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3 (Ag3PO4 kết tủa vàng)
5. Cách nhận biết muối amoni (NH4)+
Nhận biết muối amoni bằng cách sử dụng dung dịch kiềm như NaOH => xuất hiện hiện tượng có mùi khai
Ví dụ: NH4Cl + NaOH → NH3↑ + NaCl + H2O (NH3↑ có mùi khai)
6. Cách nhận biết muối của kim loại bari
Để nhận biết dung dịch muối của kim loại bari sử dụng dung dịch axit H2SO4 loãng hoặc dung dịch muối sunfat => hiện tượng xuất hiện kết tủa trắng
Ví dụ: Ba(NO3)2 + K2SO4 → BaSO4↓ + 2KNO3 (BaSO4 kết tủa trắng)
7. Cách nhận biết dung dịch muối đồng (II)
Sử dụng dung dịch kiềm NaOH hoặc KOH để nhận biết dung dịch muối đồng II => Xuất hiện hiện tượng kết tủa màu xanh lam
Ví dụ: CuSO4+ 2NaOH → Cu(OH)2↓ + Na2SO4 (Cu(OH)2 kết tủa màu xanh lam)
8. Nhận biết muối magie
Sử dụng dung dịch kiềm NaOH hoặc KOH để nhận biết dung dịch muối magie => Xuất hiện hiện tượng kết tủa màu trắng
Ví dụ: MgCl2+ 2NaOH → Mg(OH)2↓ + 2NaCl (Mg(OH)2 kết tủa màu trắng)
9. Cách nhận biết muối trung hòa sắt (II)
Sử dụng dung dịch kiềm (KOH hoặc NaOH) để nhận biết dung dịch muối sắt II => Xuất hiện hiện tượng kết tủa màu trắng xanh
Ví dụ: FeCl2+ 2NaOH → Fe(OH)2↓ + 2NaCl ( Fe(OH)2↓ kết tủa màu trắng xanh)
10. Cách nhận biết muối trung hòa sắt (III)
Sử dụng dung dịch kiềm (KOH hoặc NaOH) để nhận biết dung dịch muối sắt III => Xuất hiện hiện tượng kết tủa màu nâu đỏ
Ví dụ: Fe(NO3)3 + 3NaOH → Fe(OH)3↓ + 3NaNO3 (Fe(OH)3 kết tủa nâu đỏ)
Ứng dụng của muối trung hòa trong đời sống

Loại muối trung hòa được ứng dụng nhiều trong đời sống
Muối trung hòa đóng vai trò quan trọng trong đời sống con người, động vật và được ứng dụng thực tế ở nhiều lĩnh vực:
-
Xử lý nước: Sử dụng muối để trung hòa các axit hoặc bazơ đạt pH mong muốn, đồng thời làm cho nước trở nên an toàn để phục vụ cho các quá trình chế biến, sản xuất.
-
Cân bằng pH: Muối sử dụng cân bằng độ pH của các dung dịch trong cơ thể, giữ ở mức phù hợp để các quá trình hóa học diễn ra hiệu quả
-
Hỗ trợ hoạt động cơ thể: Đây là muối cần thiết cho nhiều hoạt động của cơ thể như cơ bắp, thần kinh và các quá trình trao đổi chất.
-
Cung cấp khoáng chất: Muối cung cấp các khoáng chất cần thiết cho sự duy trì hoạt động và sự phát triển của cơ thể như kali, magie, canxi, natri…
-
Cân bằng điện giải: Muối có vai trò quan trọng trong việc cân bằng điện giải giữa các tế bào và giữ nước trong cơ thể
-
Điều trị các bệnh liên quan đến muối: Kiểm soát, cân bằng lượng muối này trong cơ thể hỗ trợ quan trọng trong việc điều trị một số bệnh như suy tim, loạn nhịp tim, huyết áp, bệnh thận…
Giải đáp một số thắc về muối trung hòa
nhận được một số thắc mắc về muối trung hòa đến từ khách hàng, dưới đây là giải đáp chi tiết của chúng tôi về một số câu hỏi điển hình nhất.
Muối trung hòa axit trong dạ dày là gì?
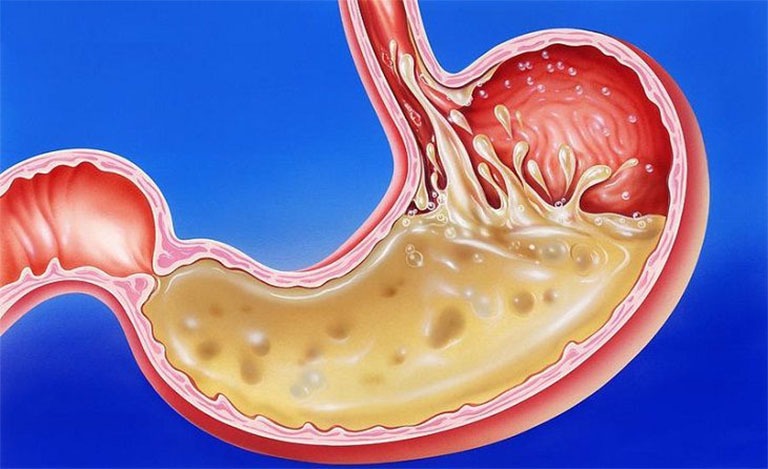
Muối trung hòa axit trong dạ dày là gì?
Các bệnh nhân bị đau dạ dày sẽ có xu hướng tiết nhiều dịch vị có thành phần axit clohidric. Vì vậy để làm giảm các triệu chứng tiết axit cần sử dụng muối trung hòa. NaHCO3 là muối trung hòa axit dạ dày thường được dùng, khi natribicarbonat đi vào cơ thể sẽ tác dụng với axit clohidric làm xuất hiện phản ứng hóa học trung hòa trực tiếp axit. Khi môi trường dạ dày giảm bớt axit sẽ làm giảm nhanh và làm dịu cơn đau.
Tuy nhiên muối NaHCO3 có ưu điểm giải quyết các triệu chứng đau do dạ dày tiết nhiều axit, không phải là phương án xử lý triệt để nguyên nhân đau dạ dày. Nếu làm dụng quá mức sẽ khiến lượng axit giảm mạnh, làm có thể phản ứng lại tiết axit nhiều hơn. Từ đó tần suất xuất hiện cơn đau ngày càng tăng.
CaCO3 có phải muối trung hòa?
CaCO3 (canxi cacbonat) là hợp chất hóa học thành phần chính của vỏ sò, đá vôi, cẩm thạch, đá phấn… có dạng bột màu trắng, chiếm 5% trong lớp vỏ trái đất. CaCO3 là muối trung hòa, có thể được sử dụng để tăng độ cứng của nước, cân bằng pH trong hồ cá, xử lý nước bể bơi, ứng dụng trong sản xuất nhựa PVC…
K2CO3 là muối trung hòa phải không?

K2CO3 là muối trung hòa phải không?
K2CO3 (kali cacbonat) là muối có màu trắng, dễ tan trong nước, không tan trong ethanol. K2CO3 là muối trung hòa và là muối kali cơ bản. Kali cacbonat được ứng dụng rộng rãi trong đời sống vào trong sản xuất công nghiệp như sản xuất kính, công nghiệp thực phẩm, sản xuất KOH, làm chất đệm trong sản xuất rượu vang, dung dịch tẩy rửa…
NaCl là muối trung hòa?
NaCl là muối ăn thường gặp trong muối biển, muối bột. Khi NaCl tan trong nước tạo thành ion Na+ và Cl– không có tính axit hay bazo nổi bật, do đó NaCl là muối trung hòa điển hình. Muối natri clorua được ứng dụng trong sản xuất công nghiệp và đời sống. Cụ thể, trong sản xuất công nghiệp muối này sử dụng rộng rãi trong ngành dệt nhuộm, công nghiệp giấy, sản xuất cao su, xử lý bể bơi, ngành thực phẩm, ngành chăn nuôi, y tế… Trong đời sống, NaCl có nhiều ứng dụng hữu ích như hỗ trợ công việc nội trợ, làm sạch vết bẩn trên quần áo, hỗ trợ vệ sinh các đồ dùng, dụng cụ…
Muối trung hòa có vai trò quan trọng trong đời sống, với sức khỏe con người và trong nhiều ngành công nghiệp, do đó việc nhận biết muối rất cần thiết. Hy vọng với những chia sẻ mà đã tổng hợp trên đây sẽ giúp bạn nắm vững các kiến thức, kỹ năng về loại muối này.




