Nằm trong số các hợp chất vô cơ nổi bật nên không có gì lạ khi muối KClO3 được ứng dụng khá nhiều. Chúng ta hoàn toàn có thể dễ dàng bắt gặp nó ở các phòng thí nghiệm, trong sản xuất nông nghiệp hoặc công nghiệp,… Trong bài viết sau sẽ mang tới cho bạn đọc đầy đủ thông tin về Kali Clorat là gì, tính chất đặc trưng và các ứng dụng trong đời sống, sản xuất.
1. Kali Clorat là gì?

Kali Clorat là gì?
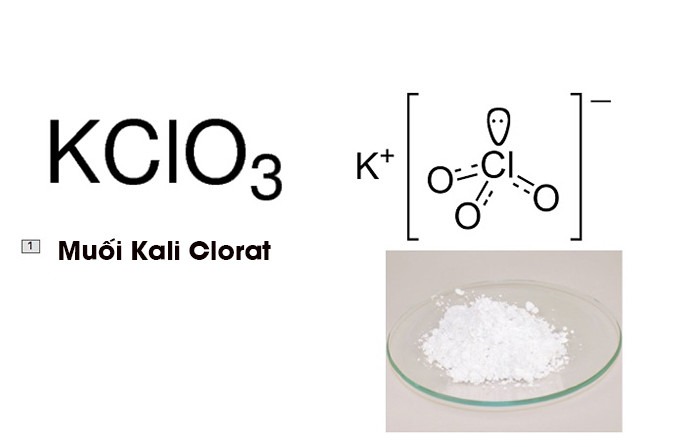
KClO3 là gi? Có thể hiểu đây là một loại muối vô cơ được tạo nên từ axit có tính oxi hóa mạnh như HClO3 (Axit Chloric). Do đó, chính bản thân nó cũng đã là một chất oxi hóa mạnh, dễ dàng tác dụng với các loại hóa chất khác. Trong một số trường hợp, khi pha trộn với tỷ lệ nhất định sau đó đun nóng sẽ gây nổ.
Công thức hóa học của Kali Clorat là KClO3, trong phân tử có liên kết tĩnh điện giữa ion Kali mang điện tích dương (+) và nhóm ClO3 mang điện tích âm (-). Nhờ vào lực hút này mà phân tử khá bền chặt và trong nhóm ClO3 còn có một cặp Electron chưa tham gia liên kết.
2. Tính chất đặc trưng của Kali Clorat
Muối Kali Clorat tồn tại ở thể rắn với các tính chất vật lý, hóa học điển hình mà không phải ai cũng hiểu. Hãy theo dõi cụ thể thông tin chia sẻ dưới đây để hiểu rõ hơn về loại muối cơ bản này nhé.
Tính chất vật lý
Kali Clorat công thức là Kali Clorat là gì? Tính chất lý hóa và ứng dụng của Kali Clorat, nhìn bằng mắt thường sẽ thấy đây là chất rắn màu trắng hoặc không có màu. Ngoài ra nó cũng có thể tồn tại ở dạng muối bột hay tinh thể kết tinh. Loại hóa chất này có vị mặn cơ bản và độc tính, khi uống từ 2 – 3 gram sẽ dẫn tới ngộ độc.
Về khả năng hòa tan trong nước, Kali Clorat khá ít tan trong nước lạnh, tuy nhiên nó lại tan nhiều trong nước nóng. Ngoài ra chúng còn có thể tan trong các hóa chất khác như Axeton, Glixerol,… Ở điều kiện nhiệt độ là 0oC, độ tan trong nước là 3,13g/ml, còn đối với nhiệt độ thường 25oC, độ tan là 8,15g/ml.
Khối lượng mol của hóa chất KClO3 là 122,5g/mol, khối lượng riêng là 2,32g/cm3. Điểm sôi của nó là 673K và điểm nóng chảy ở 629K, nhiệt dung riêng đo được của Kali Clorat là 100.25 J.mol.K
Tính chất hóa học
Tính chất hóa học của KClO3
Như đã nói từ đầu, Kali Clorat là chất oxi hóa cực mạnh, có thể tác dụng với nhiều kim loại, phi kim loại để tạo ra muối và oxit tương ứng. Điển hình trong đó, chúng ta có thể lấy một số ví dụ về các phản ứng hóa học với Al, C, P, S, Mg,….
-
3C + KClO3→ 2KCl +3CO2
-
2Al + KClO3 → Al2O3 + KCl
-
6P + 5KClO3 → 5KCl + 3P2O5
-
3S + 2KClO3 → 2KCl + 3SO2
-
3Mg + KClO3 → KCl + 3MgO
Ngoài ra, KClO3 còn rất dễ bị phân hủy, nhất là khi bị nhiệt phân sẽ sinh ra lượng lớn khí oxi nên sử dụng nhiều trong điều chế oxi diện rộng.
-
4KClO3 → 3KClO4 + KCl
-
2KClO3 → 2KCl + 3O2
3. Các cách điều chế Kali Clorat hiện nay
Sau khi hiểu rõ hơn về Kali Clorat là gì, nhiều người thường thắc mắc không biết muốn điều chế hóa chất này thực hiện ra sao, có khó không. Thật ra có khá nhiều cách chế tạo KClO3 bởi các hóa chất ngày nay đều có mặt đầy đủ nguyên tố K và Cl. Tuy nhiên, nhìn chung người ra vẫn thường chọn 2 cách sau để thực hiện bởi tính đơn giản, chi phí. Cụ thể:
-
Cách 1: Mọi người chỉ cần chuẩn bị nguyên liệu bao gồm dung dịch KOH và Cl2 để thực hiện phản ứng ở nhiệt độ cao, thu được sản phẩm Kali Clorat như mong muốn.
Phản ứng hóa học: 6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
-
Cách 2: Đối với cách làm KClO3 này sẽ được áp dụng chủ yếu trong các ngành công nghiệp sản xuất quy mô lớn qua phương pháp điện phân dung dịch KCl 25%.
Phản ứng hóa học: 2KCl + 2H2O → 2KOH + H2 + Cl2
4. Ứng dụng của Kali Clorat

Ứng dụng của Kali Clorat
Với tính oxy hóa nổi bật của mình, muối Kali Clorat thường được sử dụng rất nhiều trong sản xuất thuốc nổ hay ngòi nổ. Thậm chí ngay cả ngành công nghiệp pháo hóa cũng đang sử dụng lượng lớn Kali Clorat. Lượng nhiệt lớn mà hóa chất này nào tạo ra cũng được ứng dụng vào khá nhiều trong ngành công nghiệp tên lửa.
Với công nghiệp sản xuất diêm, ứng dụng KClO3 chiếm vị trí cực kỳ quan trọng bởi nó chiếm tới 50% trong hỗn hợp làm cháy nào ở đầu que diêm. Trong ngành công nghiệp nhuộm, KClO3 giúp khử màu khá tốt nên cũng được sử dụng nhiều.
Đối với khu vực phòng thí nghiệm, ứng dụng của KClO3 chính là dùng để điều chế ra khí oxi với số lượng lớn. Từ đó người ta mới dùng khí oxi này cho các phản ứng hóa học khác nhau diễn ra trong phòng thí nghiệm. Hơn nữa, để quá trình xảy ra nhanh chóng, dễ dàng hơn thì bạn nên sử dụng kèm chất xúc tác MnO2. Loại xúc tác này rất dễ sử dụng vì có giá thành không quá cao và còn an toàn cho sức khỏe con người.
Cuối cùng, trong nông nghiệp thì Kali Clorat có chứa nguyên tố Kali cực kỳ quan trọng cho đất. Nên việc sử dụng thêm hóa chất KClO3 trong nông nghiệp này sẽ giúp điều hòa cho cây trồng hay kích thích ra trái vào các mùa vụ.
5. Giải đáp thắc mắc KClO3 có độc không?

Giải đáp thắc mắc KClO3 có độc không?
Hóa chất KClO3 là một chất hóa học mặn và mát, có độc và nếu sử dụng liều lượng từ 2 – 3g hoàn toàn có thể gây ngộ độc, tử vong. Tuy nhiên, trên thực tế loại hóa chất này có thể sử dụng trong chất nổ cũng như phân bón, sơn phản quang. Do đó, ở thời điểm hiện tại nó cũng được liệt vào danh sách kinh doanh có điều kiện.
Đặc biệt, để đảm bảo an toàn và chất lượng sử dụng trong thời gian dài cần chú ý tới cách bảo quản KClO3. Nên đặt Kali Clorat tại các khu vực khô ráo, thoáng mát và tránh ánh nắng trực tiếp mặt trời hay khu vực có độ ẩm cao. Không nên để chung Kali Clorat cùng các hóa chất khác, đặc biệt là những hóa chất có khả năng gây ra phản ứng. Không sử dụng bao bì đựng hóa chất đã hết cho các mục đích khác.
6. Kali Clorat mua ở đâu đảm bảo chất lượng, chính hãng
Để mua Kali Clorat và những hóa chất xử lý nước bạn cần tìm hiểu thông tin kỹ càng. Đảm bảo địa chỉ mua hàng hoạt động hợp pháp, có đầy đủ giấy tờ hàng hóa liên quan để hạn chế tối đa rủi ro mua phải hàng giả, hàng nhái kém chất lượng. Ngoài ra bạn cũng có thể tìm đến những cơ sở hoạt động lâu năm đã được nhiều người dùng đánh giá cao về chất lượng sản phẩm, dịch vụ từ trước.
Toàn bộ thông tin xoay quanh vấn đề Kali Clorat là gì, tính chất, cách điều chế hay những ứng dụng trong sản xuất đều được chúng tôi cung cấp đầy đủ. Hy vọng bạn có thể nắm được và hiểu rõ hơn về loại muối Kali này nhờ kiến thức trên.




