Ete là một hợp chất hóa học được nhắc đến khá nhiều trong đời sống thường ngày cũng như trong chương trình hóa học phổ thông. Để hiểu rõ hơn về ete là gì cũng như những ứng dụng của ete trong đời sống, các bạn hãy cùng dành chút thời gian và theo dõi bài viết về ete dưới đây nhé.
Ete là gì?
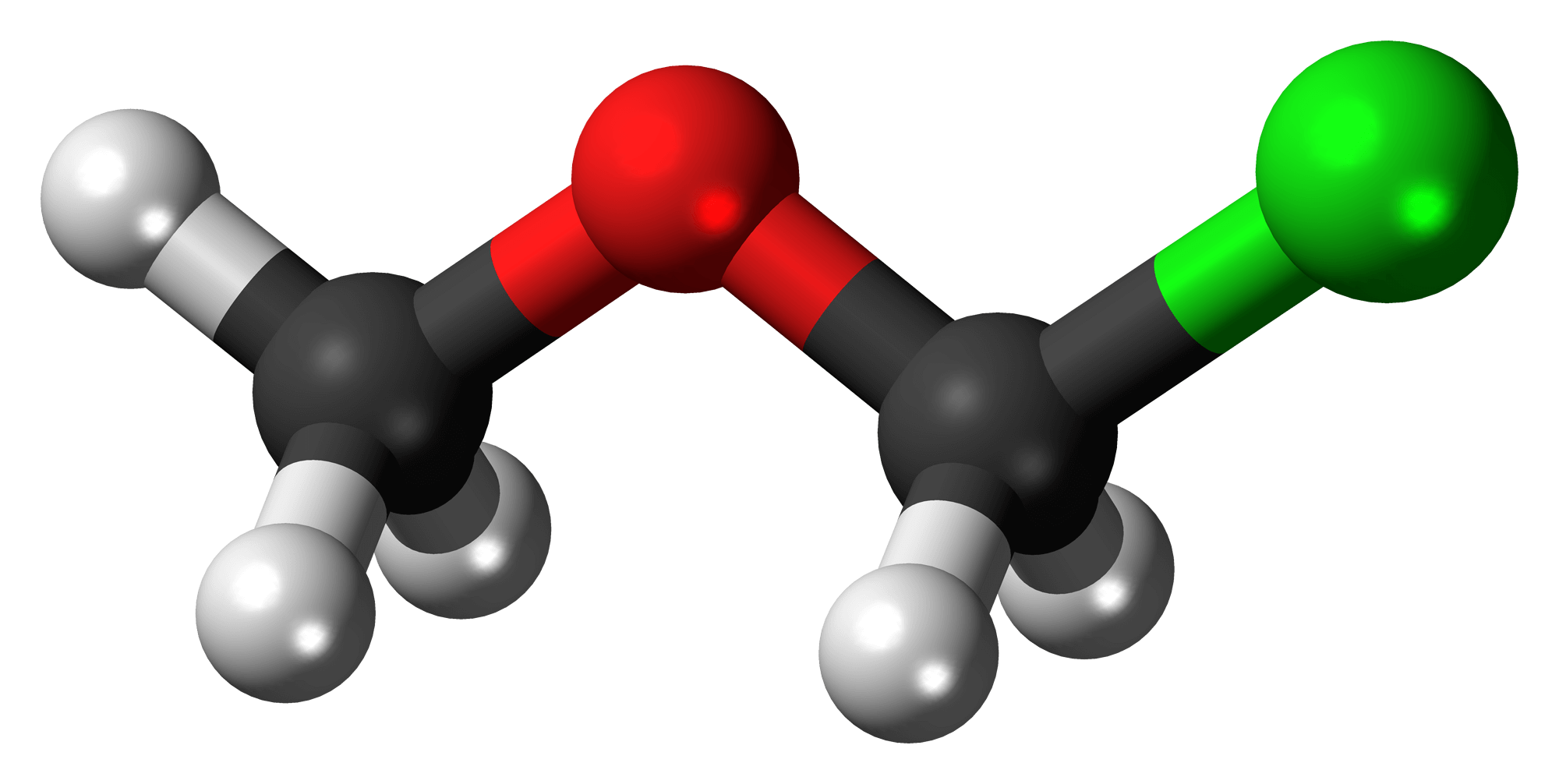
Ete là gì
Ete hay ête là tên gọi của những hợp chất hữu cơ có chứa nhóm chức ete, cụ thể là nguyên tử oxy liên kết 2 nhóm ankyl. Ví dụ như dietyl ete có công thức hóa học là CH3-CH2-O-CH2-CH3.
Ete hóa là quá trình tạo ra ete từ ancol, ví dụ như phản ứng tạo đietyl ete từ C2H5OH trong điều kiện nhiệt độ 140 độ C, xúc tác H2SO4
2C2H5OH → C2H5-O-C2H5 + H2O
Trong rất nhiều loại ete thì có một số loại loại ete quan trọng, đó là:
- Etylen oxit: Ete vòng nhỏ nhất.
- Đimetyl ete: Chất đẩy bên trong bình xịt.
- Đietyl ete: Dung môi thông dụng có điểm sôi thấp.
- Đioxan: Ete vòng có điểm sôi cao
- THF: Ete vòng, một trong những ete phân cực đơn giản nhất được sử dụng làm dung môi.
- Anisol: Thành phần chính có trong tinh dầu hồi.
- Các ete vòng hoa: Sử dụng làm chất xúc tác chuyển pha.
Công thức hóa học của ete là gì?
Công thức hóa học của ete là R-O-R’. Tuy nhiên, không phải hợp chất nào có công thức này cũng là ete, ví dụ như:
- Những hợp chất vòng thơm mà trong đó có nguyên tử O là một phần của vòng thơm.
- Những hợp chất mà trong đó một trong số các nguyên tử C tiếp ngay sau nguyên tử O sẽ được liên kết với O, N hoặc S.
- Các este: R-C(=O)-O-R
- Các aminal: R-CH(-NH-R)-O-R
- Các axetat: R-CH-O-R)-O-R
- Các anhydrit R-C(=O)-O-C(=O)-R
Tính chất đặc trưng của các ete
Tính chất đặc trưng của ete là gì
Tính chất vật lý
– Ete tồn tại ở dạng lỏng, không màu và có mùi dễ chịu khi ở nhiệt độ phòng, trừ dimetyl ete và etyl metyl ete tồn tại ở dạng khí. So với rượu, ete thường nhẹ hơn và cũng có độ tan trong nước thấp hơn.
– Momen lưỡng cực của ete nhỏ do góc liên kết COC không phải là 180° và momen lưỡng cực của 2 liên kết CO không triệt tiêu lẫn nhau.
– Tính phân cực của ete thấp hơn este, ancol và amin vì nguyên tử O không thể tham gia liên kết hydro do có sự hiện diện của các nhóm alkyl ở cả 2 phía của nguyên tử O. Tuy nhiên so với anken thì ete phân cực hơn.
– Điểm sôi của các phân tử ete tương đương ankan nhưng lại thấp hơn nhiều so với alcol có cùng khối lượng phân tử. Nguyên nhân của việc này là do sự hiện diện của liên kết hidro trong alcol.
– Độ tan của ete trong nước tương đương với độ tan của ancol có cùng phân tử khối. Các phân tử ete hòa tan trong nước là do nó có thể tạo liên kết hidro với một phân tử nước. Khi nguyên tử C tăng lên, độ tan sẽ giảm đi do sự gia tăng tương đối của lượng hydrocacbon trong phân tử khiến cho xu hướng hình thành liên kết H bị giả.
– Các phân tử ete không thể tạo ra liên kết hidro với nhau nên điểm sôi của nó tương đối thấp khi so sánh cùng ancol tương tự
Tính chất hóa học
– Phản ứng tách: Phản ứng hóa học của ete rất kém. Khi bị đốt nóng cùng BF3 hoặc đun sôi trong HBr, ete sẽ bị phân hủy. Chúng ta có thể chia cắt các ete bằng các axit vô cơ chứa halogen thấp như HCl, tuy nhiên, quá trình này diễn ra rất chậm. Chỉ có HBr và HI mới có thể chia cắt ete với tốc độ nhận thấy được.
– Phản ứng tự oxy hóa (phản ứng cháy): Khi tiếp xúc với không khí có sự hiện diện của tia UV hoặc ánh sáng mặt trời, liên kết peroxide sẽ được hình thành trong ete.
– Phản ứng giống như các bazơ Lewis, ví dụ đietyl ete tạo ra phức chất với các hợp chất của B như F3B:O(CH2CH3)2 (triflorua bo dietyl eterat).
– Đối với các epoxit hoặc ete vòng, trong các vòng thì 3 thành viên rất dễ bị tổn thương bởi những tấn công kiểu ái lực hạt nhân.
– Những ete bậc nhất và bậc 2 có nhóm OH ngay sau nguyên tử O của ete rất dễ dàng tạo thành các epoxit hữu cơ có khả năng gây nổ cao khi có oxy, ánh sáng, kim loại và các tạp chất aldehit. Chính vì vậy mà các ete như dietyl ete và THF thường không được sử dụng để làm dung môi trong các hoạt động sản xuất công nghiệp.
– Phản ứng halogen hóa:
Phenyl alkyl ete trong vòng benzene thực hiện phản ứng halogen hóa thông thường. Ví dụ như anisole tác dụng với brom trong axit ethanoic dù không có xúc tác là sắt (III) bromua. Nguyên nhân là do sự kích hoạt vòng benzen bởi nhóm methoxy.
– Phản ứng nitrat hóa:
Khi anisole được nitrat hóa bởi hỗn hợp axit nitric và axit sulfuric đặc, nó sẽ tạo ra hỗn hợp para-Nitroanisole (chính) và ortho-Nitroanisole.
Ete được điều chế như thế nào?

Ete được điều chế như nào
Việc điều chế ete có thể được thực hiện theo một trong những cách dưới đây:
– Khử nước của ancol (Phương pháp này thường ít được áp dụng trong thực tế)
Phản ứng khử nước của ancol sẽ cần thêm xúc tác là axit sunfuric, axit photphoric… để tạo ra anken và ete. Tùy điều kiện phản ứng mà các sản phẩm tạo thành sẽ khác nhau.
ROH + ROH → ROR + H2O
– Phản ứng tổng hợp Williamson
RO– + RX → ROR + X–
Trong phản ứng tổng hợp Williamson, một ankyl halogenua sẽ được tạo ra để phản ứng với natri ankoxide nhằm tạo ra ete. Quá trình này sẽ bao gồm việc xử lý rượu với các bazo mạnh để tạo ra anion ankoxide, tiếp đó là thêm vào một lượng vừa đủ hợp chất béo chứa nhóm thế phù hợp (R-X). Những nhóm thế thích hợp sẽ là iodide, bromide hoặc sunfonat.
Phương pháp này tạo ra kết quả tốt nhất đối với các nguyên tử cacbon bậc 1, bởi lẽ các nguyên tử cacbon bậc 2 sẽ tham gia phản ứng khử E2 khi tiếp xúc với các anion ankoxide gốc dùng trong phản ứng. Các ee gốc aryl có thể được điều chế bằng phản ứng tổng hợp ete Ullmann.
Những ứng dụng quan trọng của ete
Ete được ứng dụng rộng rãi trong cuộc sống và ứng với mỗi loại sẽ lại có những công dụng khác nhau, cụ thể là:
– Diethyl ete (C2H5)2O thường được sử dụng dưới dạng dung môi và chủ yếu được dùng làm thuốc gây mê. Nó được sử dụng để gây mê trong suốt quá trình phẫu thuật thông qua đường hô hấp. Tuy nhiên, việc sử dụng hợp chất này có thể dẫn đến một vài tác dụng phụ sau phẫu thuật là khó thở, buồn nôn, nôn,… Chính vì vậy mà hiện nay, nó đã bị thay thế bằng loại thuốc gây mê khác.
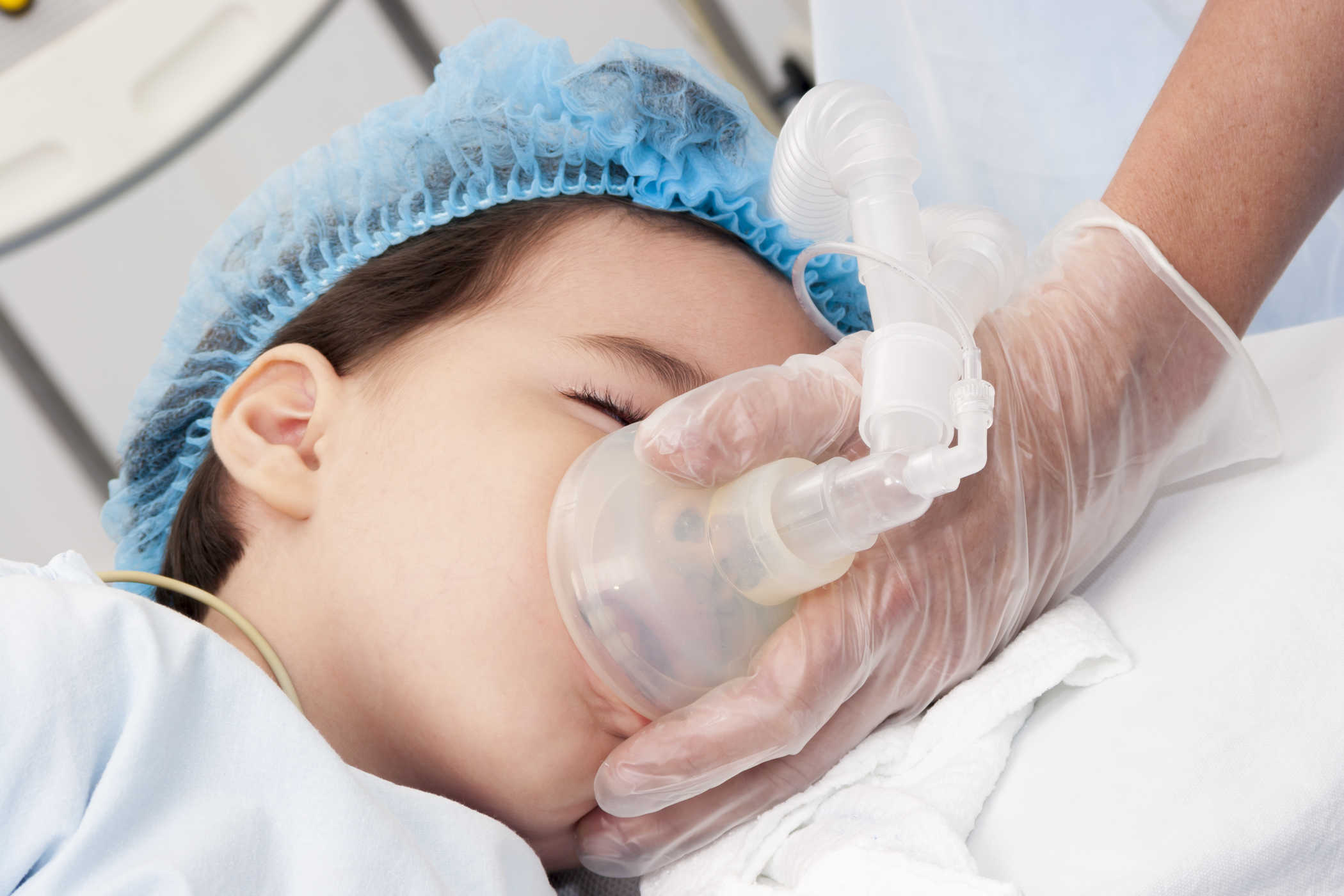
Ete được sử dụng làm chất gây mê
– Trong phòng thí nghiệm, diethyl ete cũng là một loại dung môi được sử dụng rất nhiều. Vì khả năng hòa tan trong nước bị hạn chế, chỉ 6,9 g/100ml và trong điều kiện nhiệt độ nước là 25 độ C thì là 1,5 g/100ml, diethyl ete được dùng để phản ứng với Grignard và tham gia nhiều phản ứng khác.
– Trong sản xuất công nghiệp, diethyl ete được dùng làm nhiên liệu, động cơ đánh lửa theo mô hình carbureted nén. Nhờ có số cetane cao 85 – 96 (độ bay hơi cao và điểm chớp cháy thấp) mà diethyl ete còn được sử dụng làm chất lỏng khởi đầu, kết hợp cùng các sản phẩm chưng cất dầu mỡ cho động cơ diesel và xăng.
Ngoài ra, loại ete này còn được dùng trong quá trình sản xuất nhựa cellulose.
– Dimethyl ether hay metoxymethan (CH3OCH3) là loại ete đơn giản nhất được sử dụng để sản xuất chất dimethyl sulfat, methyl hóa, dẫn tới phản ứng của nó với SO3:
CH3OCH3 + SO3 → (CH3)2SO4
Dimethyl ete cũng có thể tạo thành axit axetic thông qua phương pháp carbonyl hóa
(CH3)2O + 2CO + H2O → 2CH3CO2H
Ngoài ra, dimethyl ete còn là một loại thuốc thử được dùng trong các phòng thí nghiệm và là chất quan trọng trong sản xuất keo xịt.
Với những chia sẻ của về ete là gì, các bạn chắc hẳn đã hiểu rõ hơn về hóa chất này, từ tính chất, cách điều chế cho đến những ứng dụng của nó.




