Hidrocacbon là một hợp chất hữu cơ được liên kết bởi cacbon (C) và hidro (H) bằng các liên kết 1, 2 hoặc 3. Bài viết này chúng ta sẽ cùng nhau tìm chi tiết về hidrocacbon no và không no, hiểu rõ về đặc điểm, tính chất và những ứng dụng của chúng trong cuộc sống. Bài viết là những thông hữu ích, được chia sẻ bởi các chuyên gia ngành hoá chất đang công tác và làm việc tại
1. Hidrocacbon no là gì?
Hidrocacbon no là một loại Hiđrocacbon mà các nguyên tử Cacbon trong phân tử liên kết với nhau bằng liên kết đơn. Những hoá trị còn lại sẽ bị bão hoà bởi nguyên tử hydrogen. Hiđrocacbon no được chia thành 2 loại đó là: Alkane (paraffin) và Cycloalkane. Mỗi loại sẽ có những đặc điểm và tính chất khác nhau.
1.1. Hidrocacbon no Ankan
Trong chuỗi Hidrocacbon no và không no thì Ankan thuộc no, trong mỗi phân tử đều có chứa số nguyên tử hidro cực đại và không chứa các liên kết đôi. Công thức hóa học của Ankan là CnH2n+2 (n≥1).
-
Tên gọi: Số chỉ vị trí nhánh + tên nhánh + mạch nhánh chín + đuôi an
-
Ngoại quan: Ở nhiệt độ thường các ankan từ C1 – C4 tồn tại ở trạng thái khí, từ C5 – C10 tồn tại ở trạng thái lỏng, từ C10 trở lên tồn tại ở trạng thái rắn.
-
Tính tan: Ankan đem đến khả năng cách điện tốt và tan tốt trong các dung môi hữu cơ, hòa tan ít trong nước
-
Tính chất hóa học: Phản ứng halogen hóa, phản ứng tách hydro hóa, phản ứng cracking hay phản ứng gãy mạch cacbon, phản ứng oxy hóa hoàn toàn.
-
Ứng dụng: Ankan được ứng dụng làm nhiên liệu và điều chế các chất sinh hàn thông qua phản ứng oxi hóa không hoàn toàn, thành phẩm thu được như axit axetic, rượu etylic, HCHO… Ngoài ra, một số loại ankan còn được dùng làm dầu bôi trơn máy móc và dung môi hữu cơ.
1.2. Hidrocacbon no Cycloalkane
Cycloalkane thuộc nhóm Hidrocacbon no mạch vòng, trong phân tử chỉ có chứa liên kết đơn. Công thức tổng quát là CnH2n (n ≥ 3) với các tính chất hóa lý sau đây:
-
Tên gọi: Số chỉ vị trí nhánh + tên nhánh + xiclo + tên mạch chính + đuôi an
-
Ngoại quan: Tồn tại ở dạng khí, dạng lỏng và dạng rắn tùy vào trọng lượng phân tử và điều kiện nhiệt độ.
-
Tính tan: Cycloalkane không tan trong nước nhưng tan hoàn toàn trong các loại dung môi hữu cơ.
-
Tính chất hóa học: Phản ứng thế, phản ứng cộng mở vòng, phản ứng cháy.
-
Ứng dụng: Hidrocacbon no là thành phần trong dầu nhờn, nhiên liệu động cơ, ngoài ra nó còn được dùng để sản xuất benzene, toluene, xylene…
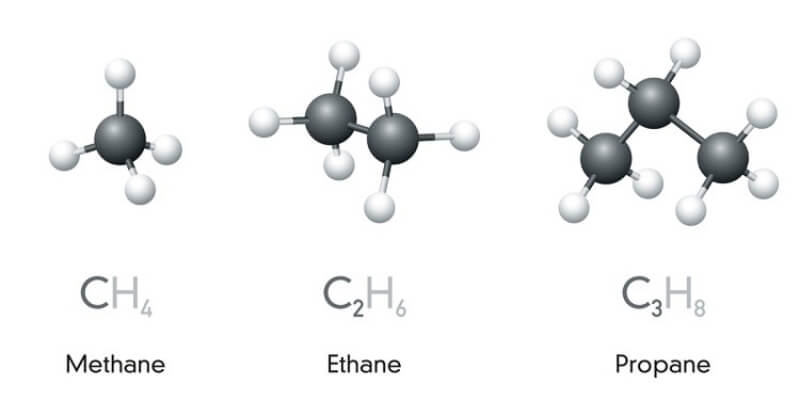
Hidrocacbon no
2. Hidrocacbon không no là gì?
Khi phân loại hidrocacbon no và không no chúng ta cần nắm được Hidrocacbon không no là gì? Hidrocacbon không no được định nghĩa là các hidrocacbon có chứa ít nhất một liên kết đôi trở nên trong cấu trúc phân tử của nó. Tuy nhiên, trong phân tử của những chất này không có mạch vòng mà chỉ có dạng mạch thẳng hoặc phân nhánh.
2.1. Phân loại Hidrocacbon không no
Hidrocacbon không no được chia thành 3 nhóm chính:
-
Thứ nhất: Anken công thức tổng quát là CnH2n với n≥2.
-
Thứ hai: Ankadien trong phân tử có hai liên kết đôi, công thức tổng quát là CnH2n-2 với n≥3.
-
Thứ ba: Ankin trong phân tử có một liên kết ba, công thức tổng quát là CnH2n-2 với n≥2
2.2. Tính chất hóa học của Hidrocacbon không no
Đa số các loại Hidrocacbon không no mang đầy đủ các tính chất đặc trưng sau đây:
-
Tham gia phản ứng với Hidro để tạo thành Hidrocacbon no
-
Phản ứng oxi hóa với đầy đủ các phản ứng cháy, anđehit hóa hay rượu hóa.
-
Phản ứng với hidro clorua để tạo thành các dẫn xuất halogen
-
Phản ứng cháy của Anken: CnH2n+(3n2)O2→nCO2+nH2O
-
Phản ứng cháy của ankin và ankadien:
CnH2n-2+((3n-1)/2)O2→nCO+(n-1)H2O
Hiện nay, các loại Hidrocacbon không no được sử dụng phổ biến trong sản xuất công nghiệp. Chuyên dùng trong sản xuất keo dán, sản xuất chất dẻo PVC, PE, sản xuất axit hữu cơ, sản xuất nguyên liệu hóa học…
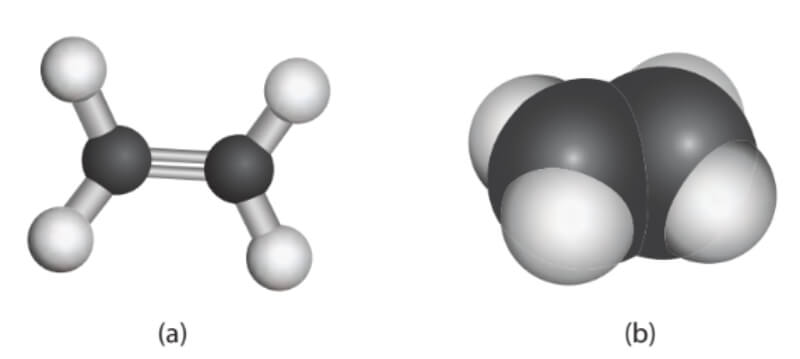
Hidrocacbon không no
3. Hiểu đúng về gốc hidrocacbon
Sau khi đã được giải đáp chi tiết về Hidrocacbon no và không no, chắc hẳn bạn muốn tìm hiểu kỹ hơn về gốc hidrocacbon. Nó được định nghĩa là phần còn lại sau khi tách một hoặc nhiều số nguyên tử Hidro khỏi một phân tử Hidrocacbon.
Ví dụ:
-
Gốc Hiđrocacbon CH3 được tạo thành sau khi tách một nguyên tử Hidro khỏi phân tử Metan.
-
Gốc Hidrocacbon C6H5 được tạo thành sau khi tách một nguyên tử Hidro khỏi phân tử Benzen C6H6.
-
Gốc Hidrocacbon C6H4 được tạo thành sau khi tác hai nguyên tử Hidro khỏi Benzen C6H6.

Hiểu đúng về gốc hidrocacbon
4. Các Hidrocacbon no và không no thường gặp
Hidrocacbon no và không no thường gặp trong các bài tập hóa học hữu cơ và được sử dụng rộng rãi trong đời sống, sản xuất công nghiệp. Đặc biệt là các chất sau đây:
– Các Hidrocacbon không no:
-
Ethan công thức là C2H6
-
Ethen công thức là C2H4
-
Ethyn công thức là C2H2
-
Propan công thức là CH3CH2CH3
-
Propen công thức là CH3CH=CH2
-
Propyn công thức là CH3C≡CH
-
Butan công thức là CH3CH2CH2CH3
-
But-1-en công thức là CH2=CH−CH2CH3
-
But-1-yn công thức là CH≡C-CH2CH3
– Các Hidrocacbon no:
-
Propane công thức là C8H8
-
Butane công thức là C4H10
-
Ethane công thức là C2H6
Hy vọng với những thông tin vừa rồi sẽ giúp bạn đọc hiểu rõ hơn về Hidrocacbon no và không no. Nếu còn câu hỏi liên quan đến hóa chất hãy để lại dưới comment để được giải đáp chi tiết nhất. là đơn vị chuyên sản xuất và cung cấp hóa chất HCl, xút công nghiệp, Chlorine số lượng lớn trên toàn quốc. Liên hệ HOTLINE để được báo giá tốt nhất.




